虽然人类文明与细菌、病毒、瘟疫斗争的历史延续千年,但全球新冠肺炎疫情带来的挑战史无前例。截至2020年9月3日,全球累计确诊新冠肺炎病例超2600万,90个国家确诊病例超过万例。其中美国新冠病毒感染确诊案例突破600万,因新冠病毒感染死亡人数已向20万逼近。
新冠肺炎病例已被发现10个月,大多数国家愈来愈把希望集中于疫苗的问世,疫苗甚至成为社会和经济发展的指引。
好消息是,截至记者发稿,已有7款疫苗进入三期临床。来自世界各地的杰出疫苗科学家已将30款实验性疫苗在人体上进行了测试。这是前所未有的。这带来的希望是:如果一款疫苗失败了,还会有很多其他疫苗延续希望。
然而,新冠病毒疫苗研发仍面临三个问题:速度、规模和公平。
疫苗的开发,一般需要10年到15年的时间,要经过前期动物试验,Ⅰ期、Ⅱ期、Ⅲ期人体临床试验,上市审批、生产分发等六步骤。
如今新冠病毒疫苗的研发,正在打破各种常规:一二期临床试验同时进行,审批机构加速临床审批,对上市审批的加速流程也在跃跃欲试。
世界卫生组织(WHO)疫苗团结试验专家团队发表评论指出,迅速投入使用新冠病毒疫苗,可能会导致我们广泛部署的疫苗实际上成为一种弱效疫苗(例如,仅能将新冠肺炎发病率降低10%-20%)。如果当地政府误认为这种疫苗可大幅降低感染风险,或者接种这种疫苗的个体也误认为自己获得了免疫力,从而减少防控,反而可能使新冠肺炎大流行继续恶化。
还有,竞赛的成分多过全球协调和合作。彼得森国际经济研究所高级研究员查德·鲍恩(Chad Bown)对《财经》记者分析,目前体现在疫苗上的民族主义或国家优先的分配方法,将产生深远的影响。没有全球协调,各国可能会互相竞争,从而推高疫苗和相关材料的价格,造成不必要的经济和人道主义困难。现在开始进行全球合作还为时不晚,世界需要一份可强制执行的新冠病毒疫苗贸易和投资协议,使疫苗生产和全球贸易形成动态的相互依存。
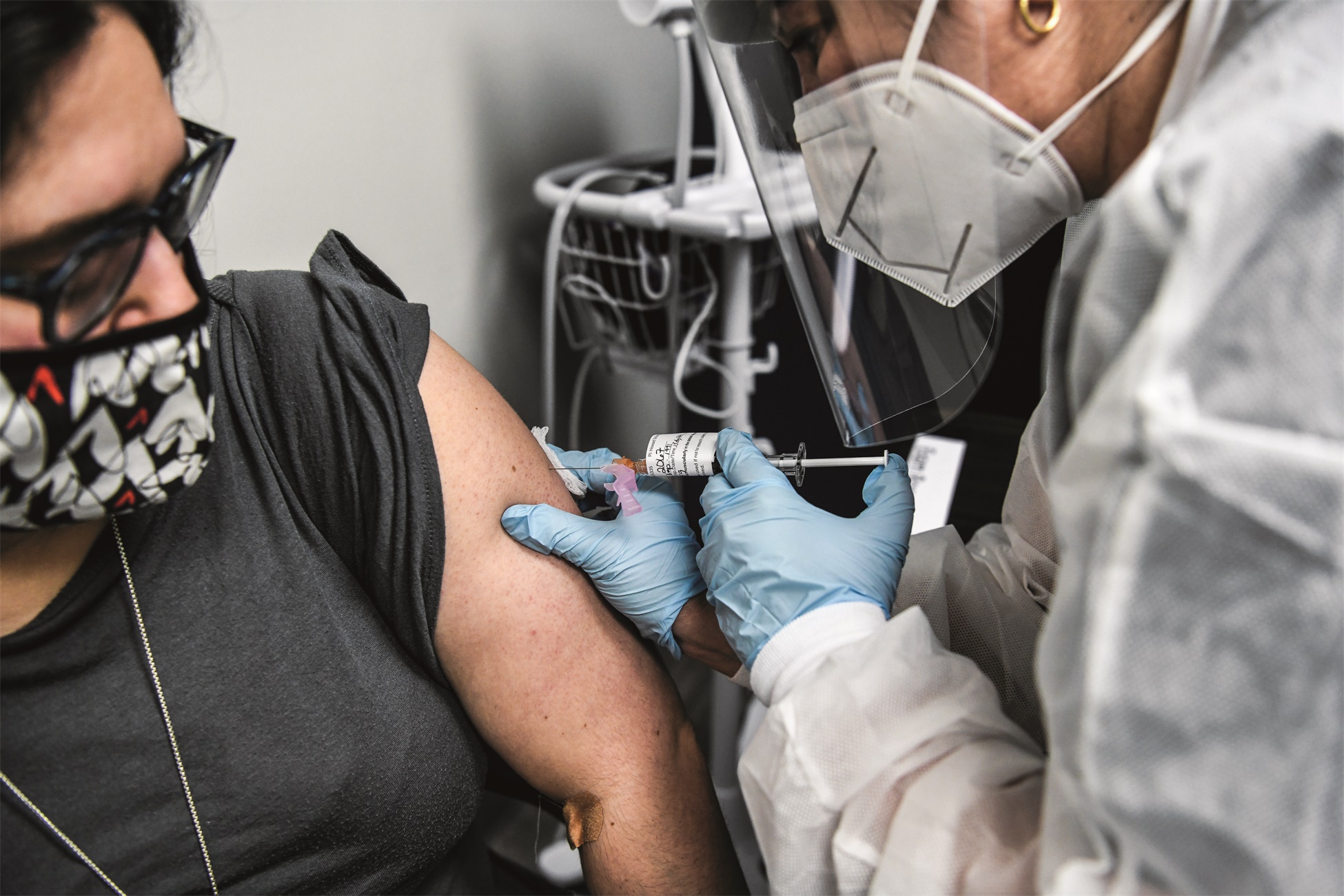
疫苗赛道最后一程
秋冬季节的临近,也意味着病毒防疫的指针进入最佳时间段内。对疫苗生产者来说,疫苗在秋冬季节获得重大突破,既为形势所迫,也为和时间赛跑。很多疫苗企业都在俄罗斯转盘的赌局上,只是设定这场赌局的是新冠病毒,赌注则是人的生命。
随着越来越接近终点,疫苗试验的细节也越来越被置于放大镜下审查。WHO数据显示,在疫苗研发的赛道上,截至8月底已集聚了170款候选者,其中33款候选疫苗迈入了临床试验阶段,其中有7款疫苗进入了最受期待的Ⅲ期临床,成为最有希望的候选者。
早在6月17日,一位接近央企的人士告诉《财经》记者,出于涉外工作的需要,员工可以自愿申请接种新冠病毒疫苗,有出国任务的、风险较高的员工优先。
《财经》记者了解到,获得紧急接种新冠疫苗机会的,仅涉及小部分央企及大型国企。疫苗来自国药集团。鉴于疫苗尚未完成三期临床试验,有效性未得到确证,因此,接种仍存有一定的风险。
国药集团的新冠病毒灭活疫苗,在6月底和8月下旬,相继获得阿联酋、巴林,以及秘鲁、摩洛哥、阿根廷三期临床试验批件,疫苗研发来自国药集团中国生物武汉生物制品研究所和北京生物制品研究所。
中国的另一个研发团队——中国军事医学研究院陈薇院士团队和康希诺生物(6185.HK),联合研发的新冠病毒疫苗,是腺病毒载体疫苗。9月2日,在收到俄罗斯联邦卫生部的临床试验申请批准后,康希诺宣布,疫苗在俄罗斯开始III期临床试验入组。
康希诺生物联合创始人、董事长宇学峰在接受《财经》记者采访时指出,新冠疫苗的研发,实际上是自己和自己比赛,就像高尔夫球比赛,看谁打的杆数少,“大家都希望一夜之间新冠病毒疫苗就研发出来,但研发有其内在规律,比如实验数据要等多少天,就是多少天”。
全球率先迈入Ⅲ期临床试验关键节点的还有,牛津大学和阿斯利康联合研发的也是腺病毒载体疫苗(AZD1222),8月31日,在美国进入III期临床试验。
牛津大学医学院终身教授陈铮鸣曾对《财经》记者描述说,阿斯利康处于一种战时状态:在各个方面投入很大,从研发到产能,多领域布局都快速推进。
阿斯利康正在招募近3万名18岁及以上的成年人进行试验,既包括健康人也包括有稳定的基础疾病的人,并且涵盖来自不同族裔和不同地方的志愿者。志愿者还包括艾滋病毒携带者以及新冠病毒感染风险更高的人群。阿斯利康说,该公司研发的AZD1222疫苗已在巴西、南非和英国处于最后阶段的试验,并已计划另行在日本和俄罗斯展开试验。
在美国股市获得丰厚回报的,莫过于莫德纳公司(Moderna),其与美国国立卫生研究院(NIH)合作的疫苗,于今年夏天在美国开始了有数千人参加的试验。
7月27日,莫德纳声明其研发的新冠病毒疫苗mRNA-1273进入第三阶段的研究,开始向参与者给药。7月28日,莫德纳公司在《新英格兰医学》杂志上发表的一项评估疫苗临床前研究结果表明,在非人灵长类动物的上呼吸道和下呼吸道中,mRNA-1273的两剂疫苗接种方案可产生强大的免疫反应和针对新冠病毒感染的保护作用。
8月26日,莫德纳疫苗又在人们心中燃起新的希望:莫德纳公司通过一项包括20个人的早期研究最新数据,详细介绍了该疫苗如何在老年人中发挥作用。莫德纳的试验性新冠病毒疫苗在老年人中诱导的免疫反应与在年轻参与者中相似,这说明该疫苗将对那些被认为因新冠病毒出现重症高风险的人群有效。
总部在纽约的辉瑞公司与德国的生物技术公司(BioNtech)联合开发的疫苗也在冲刺者的行列。日前其发布的最新试验数据显示,试验中的第二种候选疫苗BNT162b2 (简称B2)耐受性良好,副作用少。
辉瑞正在对B2疫苗进行大规模试验,并准备将结果在10月提交给监管机构进行审查。辉瑞公司病毒疫苗研究副总裁菲利普·多米策(Philip Dormitzer)表示,美国的高感染率意味着试验规模在3万人以下就可能达到该公司所需要的新冠肺炎病例数。该试验正在迅速招募中,截至美东时间8月19日,已有超过9000名志愿者。
然而,如一些专家指出,首先越过临床试验终点的疫苗未必是最好的疫苗。
WHO疫苗团结试验专家团队发表评论指出,世界需要对多种新冠病毒候选疫苗进行有效、快速和可靠的评估。
攻毒路线
当大的疫情暴发时,重要的是能快速找到一个比较确定的疫苗研发途径。
从原理和技术工艺上分类,新冠病毒候选疫苗大致分为五大类技术路线:灭活疫苗、重组蛋白疫苗、减毒流感病毒载体疫苗、腺病毒载体疫苗和核酸疫苗等。
美国食品和药品监督管理局(FDA)前疫苗CMC主审官员余力对《财经》记者指出,中国康希诺生物与俄罗斯团队正在试验中的疫苗,都是使用人腺病毒作为载体。在余力看来,这一路线是有缺陷的。
人腺病毒,是一种可以感染人的病毒,通常引发人体普通感冒,人群中普遍存在着对人腺病毒的免疫力。余力分析,以人腺病毒作为载体的新冠病毒疫苗,在人体内产生免疫反应之前,人体内的抗腺病毒的中和抗体,有可能先中和了腺病毒,进而影响新冠病毒疫苗的效果。亚洲约80%到85%的人群有对人腺病毒的免疫力,欧洲人约60%。这也意味着,在中国,人腺病毒疫苗的有效性可能只有20%。
不过,宇学峰解释称,“以前,在埃博拉疫苗和肺结核疫苗的研究当中,我们已经对这类疫苗的质量、属性做了很好的研究,它是一项很成熟的技术”,另外,腺病毒载体是一个能够很好地诱导体液和细胞免疫平衡免疫机制的载体。
研究者对新冠肺炎的研究表明,很难看到抗体水平和保护性的线性相关,这使得宇学峰相信除了抗体对病毒有保护以外,一定还有其他的保护机制,比如细胞免疫机制,恰恰腺病毒载体提供了一个很好的机制。同时,腺病毒载体疫苗的优势在于可以肌肉注射,甚至可以黏膜免疫。
“大规模人群接种,需要疾控方面有足够的人力物力支持这方面的工作,至少中国的情况让腺病毒载体疫苗有可行性。”宇学峰说。
余力更看好牛津大学采用的黑猩猩腺病毒载体路线,原因是人类对黑猩猩腺病毒还没有免疫力,可以避开免疫原性对疫苗效力的影响。此前,采用同样的路线,已有多款疫苗被开发出来,包括:流感病毒疫苗、结核疫苗、丙肝疫苗等。
全球三款进入三期临床的灭活疫苗,都是中国团队研发的。其中一款由中国生物武汉生物制品研究所与中科院武汉病毒所协同攻关,另一款灭活疫苗由中国生物北京生物制品研究所与中国疾控中心病毒病预防控制所共同研发。此外,中国生物北京生物制品研究所、病毒病预防控制所、北京科兴中维生物技术有限公司合作研发的疫苗“克尔来福”也属于灭活疫苗。
中国生产的新冠病毒灭活疫苗,用的是正在流行的毒株。灭活疫苗技术自2008年以来就是中国防疫工作的核心,这归功于过去中国在SARS和禽流感等重大传染病方面的经验。
余力指出,在传统的疫苗中,活疫苗在历史上公认是最好的,根除天花、小儿麻痹用的都是活疫苗。灭活疫苗比活疫苗效果差一些,前者激活T细胞的免疫反应比较差。疫苗的功效中,防止第二次感染病毒,要靠T细胞的免疫活性。疫苗如果起不到T细胞的免疫效果,就需要不断注射。
此外,灭活疫苗对生产过程要求格外严格,需要在P3(生物安全防护三级)级别的车间内生产。因为在生产过程中,在灭活处理以前的工序,包括生长扩增、过滤浓缩、纯化阶段等,用的都是活病毒,而且浓度比疫情发生中的环境浓度还要高。
对车间等的要求,在未来可能会影响到疫苗生产规模,如果想要达到几亿人份的量产,厂商需要不断开工。据新华网信息,国药集团中国生物具备大规模灭活疫苗生产能力,申报新冠疫苗临床试验批次产量超过5万剂,量产后每批次产量超过300万剂,年产能1亿剂以上。
“我们采取的方式是自己建疫苗生产厂。新的疫苗厂就在天津,已经开始建了,6月初开工,8月中旬厂房就可以封顶。厂房整体预计年底建成,安装设备。”宇学峰告诉《财经》记者。
全球疫苗免疫联盟(Gavi)首席执行官塞斯·伯克利(Seth Berkley)分析,在新冠病毒疫苗投产后,将需要扩大规模,为全球采购10亿剂量,这将需要更多的资金。
核酸疫苗是近年来新兴的一个技术路线,其基本原理是通过特定的递送系统将编码的病毒蛋白基因RNA或DNA直接导入体内,利用人体细胞在人体内合成病毒蛋白,刺激人体产生抗体。相当于把一份记录详细的病毒档案交给人体的免疫系统。
核酸疫苗的好处是流程简单,研发速度快。不过,也存在缺陷:表达mRNA疫苗抗原和DNA疫苗抗原的细胞不是永动机,在细胞里产生抗原的数量非常少,有专家认为mRNA疫苗抗原性不好,达不到激活免疫系统的效果。
在新冠疫苗之前,Moderna公司此前研发了8种mRNA疫苗,其中只有1种进入二期临床,5种停在一期临床,还有2种没有进入临床。
不仅如此,mRNA疫苗的量产,对于厂商来说也是一个大问题。“mRNA核酸疫苗,既不能用机器生产,也不能在大肠杆菌里生产,只能在试管里做体外的聚合酶反应,量产比较困难。”余力告诉《财经》记者。
迄今为止,全球还未有一款核酸疫苗获批。
谁的疫苗
新冠肺炎疫情不但打破了疫苗开发速度的纪录,投入资金也史无前例。然而,先行者们对新冠病毒疫苗未来的市场,可能还得另作考量。
在这场疫情中,各国获得疫苗方面的行为,正在产生超出公共卫生范围的政治影响。在美国乔治敦大学全球卫生法教授劳伦斯·戈斯汀(Lawrence Gostin)看来,一款有效的疫苗将是现代历史上最重要的人类资源,他说:“我从未见过(其他)医疗产品在政治上有如此大的利害关系。”
为了世界各国在新冠疫苗研制成功并获授权使用后,能够迅速、公平地获得疫苗,世卫组织和全球疫苗免疫联盟共同提议创建了新冠病毒疫苗全球渠道计划(COVAX)。至8月,已有约172个国家加入了这一计划。
9月初,在美国大选的大背景下,一直因对疫情处置不力而承受巨大压力的特朗普政府宣布,美国不会加入COVAX计划,美国不会被一些多边组织所约束。
虽然各国都在某种程度上打破疫苗研发、审批的常规流程,但以放卫星的速度“抢跑”的是俄罗斯。8月11日,俄罗斯总统普京宣布,俄卫生部已首次对本国研制的一款新冠病毒疫苗给予国家注册,至此,俄罗斯成为全球第一个注册新冠病毒疫苗的国家。
在8月正式注册时,这款候选疫苗刚刚结束Ⅰ期与Ⅱ期临床试验,还未开启疫苗上市前必需的Ⅲ期临床试验。“未进行大规模的三期临床就批准使用,中国与美国一定要避免俄罗斯这样的做法。”中国一家研发新冠疫苗的生物制药公司负责人告诉《财经》记者,三期大规模人群的临床试验,往往能揭示一款候选疫苗的全部副作用,中国、美国、欧洲的三期临床,都是1万人起步的,俄罗斯计划才2000多。“这样的疫苗,少则数百万人,多则几亿人接种,即便是再小的副作用,也会产生全球性的影响,尤其是对儿童和老年人群体。”
围绕疫苗的各国竞争,不只存在于美国和俄罗斯。英国卫生部长汉考克就表示,英国继续引领世界的疫苗开发。这不只是口号,英国政府8月28日表示,拟采取包括修改有关法规在内的一系列新措施,以允许监管机构临时授权紧急使用安全有效性已获证明的新冠疫苗,从而拯救生命并结束疫情。
德国则以梯队的形式研发疫苗。8个正在研发的新冠疫苗项目中,美因茨的BioNTech、图宾根的CureVac和德绍的IDT Biologika公司获得了德国联邦教研部的特别资助。这3家新冠疫苗研发企业各有特色,BioNTech已进入Ⅱ/Ⅲ期临床试验,获得了大量订单;CureVac坚持技术优先,赢得了资本市场的青睐;IDT Biologika则发挥百年疫苗经验,能提供安全保障。
还有一些国家则在积极推进与各国不同种类的疫苗研发团队签署协议,以期在疫苗研发成功后第一时间获得供应。
日本政府正在和美国辉瑞公司、英国阿斯利康公司等药企协商,计划在2021年东京奥运会召开前,为所有国民提供免费的新冠疫苗接种。欧盟委员会宣布与阿斯利康达成疫苗采购协议,未来将从该公司购买4亿剂新冠疫苗。这是欧盟达成的第一份新冠疫苗购买协议。同时,欧盟还在同其他药企磋商,以多渠道购买不同类型的疫苗。
竞赛不只存在于富裕国家中。彼得森国际经济研究所(Peterson Institute)高级研究员查德·鲍恩(Chad Bown)对《财经》记者说,如果诉诸疫苗民族主义,即使那些没有疫苗生产能力的国家,也可能去威胁不向美国或其他疫苗生产国提供相关物资供给。这些威胁包括关键原料、玻璃瓶、注射器等物资的出口,也包括推高疫苗原材料的价格。一旦疫苗生产供应链受阻,只能为人类社会带来更广泛的负面影响。
世卫组织总干事谭德塞8月底表示,与合作研发和获取新冠疫苗的努力相比,争相获得疫苗的全球竞争可能导致疫苗价格呈指数级飙升。
全球疫苗免疫联盟CEO伯克利(Seth Berkley)则说,就算有30或40个国家获得了疫苗,另外150个没有,疫情还是会继续蔓延,对商业、贸易和旅游的影响也无法被消除。
(《财经》记者赵天宇对此文亦有贡献)

